本标准参照YBB00082002-2015给出的规则起草。
本标准由石家庄鑫富达医药包装有限公司提出。
本标准起草单位:石家庄鑫富达医药包装有限公司、沧州益康食品药品包装有限公司、洛阳富道生物科技有限公司。
本标准主要起草人:王锦君、赵宏苹、贾品、王文倩、刘长喜、杨春凯。
本标准为首次发布。
兽用液体疫苗聚丙烯瓶
1 范围
本标准规定了兽用液体疫苗聚丙烯瓶的术语、产品分类、技术要求、特性指标、试验方法、检验规则、标识、包装、运输和贮存。
本标准适用于直接接触兽用液体疫苗和稀释液的包装。
本标准适用于以聚丙烯(PP)为主要原料,采用注吹一次成型工艺生产的,可灌装前高温灭菌的塑料瓶。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T2828.1-2012 计数抽样检验程序 第1部分:按接收质量限(AQL)检索的逐批检验抽样计划YBB00082002-2015 口服液体药用聚丙烯瓶 《中华人民共和国兽药典》2015版《中华人民共和国药典》2015版包装材料红外光谱测定法(YBB00262004-2015)GB/T 191-2008包装储运图示标志YBB00242005-2015环氧乙烷残留量测定法GB15810-2001《一次性使用无菌注射器》
3 术语和定义
兽用液体疫苗聚丙烯瓶是采用聚丙烯(PP)为主要原料,采用注吹工艺生产的兽用液体疫苗包装瓶。
4 产品规格
5-1000ml,根据客户使用要求采用不同规格。
5 技术要求
5.1 原料
聚丙烯(PP)。
5.2 外观质量
外观质量要求应符合表1的规定。
表1 外观质量要求

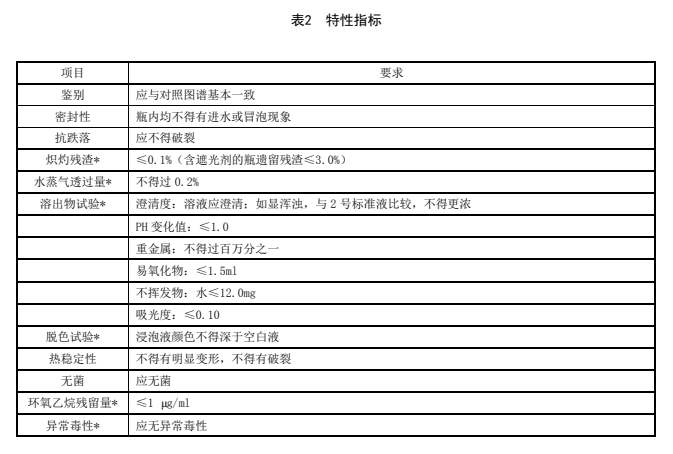
5.3 特性指标
特性指标应符合表2的规定。
表2 特性指标
6 试验方法
6.1 试验环境
温度0~30℃,相对湿度30~65%。
6.2 试样抽取
在每批生产开始时取样,按模具的腔数进行取样,确保每腔都取到。
6.3 外观质量
取本品适量,在自然光线明亮处,观察者眼睛距离试样300mm左右正视目测,观察试样外观符合表1的要求。
6.4 鉴别
取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
6.5 密封性
取本品适量,分别在瓶内装入适量玻璃珠,加胶塞铝盖使用封口器封好,置于带抽气装置的容器中,用水浸没,抽真空至真空度30kpa,维持2分钟,瓶内不得有进水或冒泡现象。
6.6 抗跌落
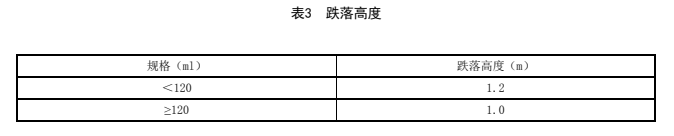
取本品适量,加入水溶液至标示容量,从规定高度(表3)自然跌落至水平刚性光滑表面,应不得破裂。
表3 跌落高度
6.7 炽灼残渣*
取本品 2.0g,依法检查(《中华人民共和国兽药典》2015年版二部通则0841)遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
6.8 水蒸气透过量*
取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法(1)在温度20℃±2℃,相对湿度65%±5%的条件下,放置14天,重量损失不得过0.2%。
6.9 溶出物试验*
供试液的制备:分别取本品平整部分内表面积600cm2(分割成长 5cm ,宽 0.3cm 的小片),置具塞锥形瓶中,加水适量,振摇洗涤小片,弃去水,重复操作二次。在 30~40℃干燥后,用水(70℃±2℃)、200ml 浸泡24小时后,取出放冷至室温,用同批试验用溶剂补充至原体积作为供试液,以同批水为空白液,进行下列试验 :
6.9.1 pH 变化值
取水供试液与水空白液各20ml,分别加入氯化钾溶液(1→1000)1.0ml,依照pH 值测定法(《中华人民共和国兽药典》2015年版二部通则0631)测定,二者差值不超过1.0。
6.9.2 重金属
精密量取水供试液20ml,加醋酸盐缓冲液(pH 3.5) 2ml,依法检查(《中华人民共和国兽药典》2015年版二部通则0821第一法),含重金属不得过百万分之一。
6.9.3 易氧化物
精密量取水供试液20ml,精密加入高锰酸钾滴定液(0.002mol/L)20ml与稀硫酸1ml,煮沸3分钟,迅速冷却。加0.1g碘化钾,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol/L)滴定,滴定至终点时,再加入淀粉指示液5滴,继续滴定至无色。另取水空白液同法操作,二者消耗硫代硫酸钠滴定液(0.01mol/L)之差不得过1.5ml。
6.9.4 不挥发物
分别精密量取水供试液与空白液各50ml置于已恒重的蒸发皿中,水浴蒸干,105℃干燥2小时,冷却后,精密称定,水不挥发物残渣与其空白液残渣之差不得过12.0mg。
6.9.5 澄清度
取水供试液,依法检查(《中华人民共和国兽药典》2015版二部通则),溶液应澄清,如显浑浊,与2号浊度标准液比较,不得更浓。
6.9.6 吸光度
取水供试液适量,照紫外-可见分光光度法(《中华人民共和国兽药典》2015年版二部通则0401)测定,在220~360nm波长范围内的最大吸光度不得过0.10。
6.10 脱色试验(着色瓶)*
取本品适量,截取表面积50 cm2(以内表面积计)三份,剪成2cm×0.3cm的小片,分别置于3个具塞锥形瓶中,分别加入4%醋酸溶液(60℃ ±2℃)、65%乙醇(25℃±2 ℃)、正己烷(25℃±2 ℃)水浴中恒温2小时后,取出放冷至室温,以同批4%醋酸溶液、65% 乙醇、正己烷为空白液,浸泡液颜色不得深于空白液。
6.11 热稳定性
(适用于灌装前蒸汽灭菌产品)取本品适量,置高压蒸汽灭菌器内,在15~20分钟内由室温均匀升至110℃,保持30分钟或121℃,保持15分钟。自然冷却至高压蒸汽灭菌器内的压力与外界相同,打开高压蒸汽灭菌器盖,取出样品观察,不得有破裂,不得有明显变形。
6.12 无菌
(灭菌后)取本品适量,加入1/2 标示容量的氯化钠注射液,盖好胶塞,振摇1分钟,合并提取液。照无菌检查法(《中华人民共和国兽药典》2015年版三部附录3306)检查,应符合规定。
6.13 环氧乙烷残留量*
此项目适用于采用环氧乙烷灭菌的产品。样品制备:取本品除去包装,吸入标示容量(V)的蒸馏水,在37℃±1℃的条件下平衡1小时。对照贮备液制备:取外部干燥的50ml容量瓶,加水30ml,加瓶塞,称重,精确到0.1mg。用注射器注入0.6ml环氧乙烷对照品(纯度大于99.7%),轻轻摇匀,再盖好瓶塞,称重,两次称重之差即为环氧乙烷重量。加水至刻度再将此溶液稀释成1g/L作为对照贮备液。在稀释成环氧乙烷含量为1µg/ml的溶液,作为对照液。将对照液和样品各取5ml置顶空瓶,分别置于60℃.
6.14 异常毒性*
取本品数只,用水清洗干净后,剪碎,取500cm2(以内表面积计),加入氯化钠注射液50ml,置高压蒸气灭菌器110℃保持30分钟后取出,冷却后备用,以同批氯化钠注射液做空白,静脉注射,依法检查(《中华人民共和国兽药典》2015年版二部附录1111),应符合规定。
7 检验规则
7.1 检验分类
产品检验分为出厂检验、型式检验、监督检验。
7.2 型式检验
7.2.1 在有下列情况之一时,应进行型式检验:
a) 新产品备案;
b) 产品出现重大质量事故后,重新生产;
c) 监督抽验;
d) 产品停产后,重新恢复生产;
e) 每年至少进行一次型式检验;
f) 带*项目半年内至少检查一次。
7.2.2 型式检验项目应包括外观质量、特性指标。
7.3 出厂检验
7.3.1 每批产品经制造商质量检验部门检验合格,并附产品合格证后方能出厂。
7.3.2 出厂检测项目按 6.3/6.4/6.5/6.6/6.11/6.12 的要求进行产品检验,检验项目包括外观质量、特性指标等。
7.3.3 按 GB/T 2828.1-2012 中正常检查一次抽样方案进行,检验项目、接收质量限 AQL 级检验水平
见表 4
7.3.4 检验结果中,按照计数抽样检验程序第 1 部分:按接收质量限(AQL)检索的逐批检验抽样计划(GB/T2828.1-2012)判定密封性不合格的,则判为不合格;其他项目中如有不合格的,允许加倍抽样对不合格项目进行复检,如复检仍有不合格项,则判该批产品为不合格。
7.4 监督检验
监督检验时国家质量监督机构按照规定对生产厂家进行抽样检验的活动。
7.5 检验批
用具有同一性质、质量和同一配方,并在同一连续生产周期中生产出来的一定数量的产品为一批。
8 标识、包装、运输、贮存
8.1 标识
每个产品的小包装上应有下列标志:
a) 产品名称及商标;
b) 厂名和厂址;
c) 批号、型号规格;
d) 执行标准编号;
e) 生产日期;
f) 产品大包装上除应有以上的标志外,还应标明数量,“怕雨”﹑“怕晒”﹑“堆码层数极限
N=8”等标志应符合 GB/T 191-2008 的有关规定。
8.2 包装
纸箱做外包装,塑料袋做内包装,置干燥通风处保存。
8.3 运输
运输中应注意防晒,防雨雪。不得与有毒或有害物品混合运输。
8.4 贮存
贮存环境要求应为干燥、通风良好的室内,周围无有害或腐蚀性物品。
复验期:24 个月。
原文下载:![]() 兽用液体疫苗聚丙烯瓶团体标准.pdf
兽用液体疫苗聚丙烯瓶团体标准.pdf
 咨询热线:400-888-1942
咨询热线:400-888-1942





